O QUE É LEUCEMIA MIELÓIDE – LMC?
A LMC é um tipo de leucemia que progride devagar (crônica) e envolve as células mieloides da medula óssea.
A LMC é classificada pela Organização Mundial da Saúde (OMS) como uma “neoplasia mieloproliferativa” (quando a medula óssea produz células sanguíneas em excesso).
Pacientes com LMC apresentam uma superprodução de glóbulos brancos e normalmente têm uma evolução lenta no crescimento das células doentes ao longo do tempo. Isso pode causar anemia, fadiga, infecções, sangramentos e outros problemas. Mas alguns pacientes são completamente assintomáticos e a doença é descoberta em um exame comum de sangue.
INIBIDORES TIROSINA QUINASE E A QUALIDADE DE VIDA DOS PACIENTES COM LMC
Desde o lançamento da terapia com inibidores da tirosina quinase em 2001, a leucemia mieloide crônica (LMC) passou a ser uma doença crônica e controlável para a maioria dos pacientes. As pessoas estão vivendo normalmente com a LMC e com menos efeitos colaterais. Podemos praticamente afirmar que o uso contínuo destas medicações conferiu uma espécie de “cura funcional” aos pacientes. Isto é, a grande maioria fica em remissão completa enquanto em uso desta medicação.
Quanto mais você souber sobre a sua doença, melhor você poderá cuidar de si mesmo, da sua mente, do seu corpo e da sua saúde. Esse manual oferece informações sobre a LMC, sobre o sangue e a medula óssea saudáveis, explica termos complicados, exames e tratamentos que você pode encontrar e lista opções de pesquisas e estudos clínicos.
Nós acreditamos que as informações contidas neste site irão lhe fornecer um conhecimento útil ou irão reforçar o que você já sabe. Nós esperamos que você o acesso sempre que quiser, e caso se sinta sozinho, enfrentando problemas relacionados à doença, poderá usá-lo para obter informações, orientações, assistência para localizar o suporte e os recursos que precisa, e ainda para entrar em contato com a equipe de apoio ao paciente e esclarecer suas dúvidas sobre a LMC.
O que causa Leucemia Mieloide Crônica?
Ninguém nasce com LMC. Ela não é hereditária. Ela acontece quando ocorre uma alteração do cromossomo na da medula óssea. A célula alterada se multiplica incontrolavelmente e elimina os glóbulos vermelhos, os glóbulos brancos e as plaquetas saudáveis da medula óssea. As células da LMC então espalham-se pela corrente sanguínea. Como a LMC é uma leucemia de progressão lenta, o desenvolvimento das células maduras normais não é totalmente comprometido, independente se elas forem vermelhas, brancas ou plaquetas. Como resultado disso, a LMC é, no geral, menos agressiva que as leucemias agudas, e normalmente os pacientes ainda não apresentam sintomas quando diagnosticados.
Um fator de risco é qualquer fator que possa aumentar a chance de alguém desenvolver uma doença.
Os Fatores de risco considerados para LMC são:
- Sexo
A LMC é um pouco mais comum em homens que em mulheres.
- Idade.
A chance de desenvolver LMC aumenta com a idade.
- Exposição à radiação.
Em um pequeno número de pacientes, a LMC é causada devido à exposição a altas doses de radiação (como ser sobrevivente de um ataque atômico ou de um acidente de reator nuclear). Um pequeno aumento também ocorre em algumas pessoas submetidas a altas doses de radioterapia como tratamento para outros cânceres, como linfoma. Porém, a maioria das pessoas que trataram um câncer com radioterapia não desenvolve LMC, e a maioria das pessoas que tem LMC não foram expostas a altas doses de radiação. Exposição a radiografia odontológica ou médica não foi associada com o aumento do risco de desenvolver LMC.
Perfil Demográfico da Leucemia Mieloide Crônica?
A LMC é uma doença relativamente rara. É um pouco mais comum em homens do que em mulheres e a maioria dos casos ocorre em adultos. Poucas crianças desenvolvem essa doença.
Incidência específica por idade. Entre 2009-2013 nos Estados Unidos.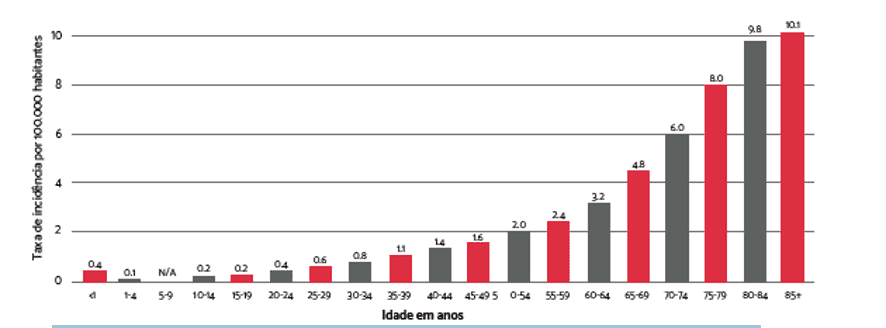
As
linhas horizontais mostram as taxas de incidência. As barras verticais
mostram a frequência de novos casos de LMC a cada 100 mil pessoas, por
faixa etária.
Fonte: SEER Cancer Statistics Review, 1975-2013.
Como mostrado na Figura 1, a frequência de LMC aumenta com a idade. Aos 65 anos, a frequência é de 4,8 em 100 mil pessoas e aumenta para 10,1 em 100 mil pessoas aos 85 anos ou mais. Nos próximos anos, a incidência da LMC pode aumentar, já que a população está envelhecendo. O INCA (Instituto Nacional do Câncer) estima 10.800 casos novos de leucemia no Brasil em 2019. Como a LMC representa 15% das leucemias no adulto, pode-se estimar 1.620 casos novos de LMC no Brasil em 2019.
Crianças e jovens adultos com LMC
Uma pequena porcentagem dos pacientes diagnosticados com LMC são crianças e jovens adultos. A LMC representa cerca de 3% das leucemias em pediatria. Como a LMC é rara em crianças, existem poucos estudos pediátricos avaliando o uso dos inibidores de tirosina quinase em crianças. Consequentemente, o tratamento em crianças com LMC não é padronizado. Muitas vezes é seguido o guia desenvolvido para adultos, apesar de existirem diferenças entre a LMC em pediatria e a em adultos em termos de apresentação e progressão. Crianças com LMC devem ser tratadas por médicos que sejam especializados em tratar crianças com câncer no sangue.
Embora não existam muitos estudos focados no tratamento de pacientes pediátricos com LMC, existe uma evidência de que o imatinibe pode desacelerar o crescimento do câncer, especialmente em crianças que são tratadas antes de alcançarem a puberdade. Outros efeitos colaterais raros do imatinibe visto em adultos, como cardiotoxicidade e disfunção da tireoide, parecem ser extremamente raros em crianças. Como crianças com LMC podem receber os inibidores de tirosina quinase por muito mais tempo que os adultos, e durante a fase de crescimento, o cuidado de acompanhamento é muito importante. Além de testar as respostas dos pacientes pediátricos à terapia, os médicos também devem monitorar:
- Altura e peso
- Puberdade: os médicos devem encaminhar os pacientes a um endocrinologista se ocorrer um atraso na puberdade
- Funções da tireoide
- Coração: pacientes devem fazer um eletrocardiograma anualmente
A má aderência à terapia, particularmente em adolescentes e jovens adultos, é uma preocupação adicional. Com os inibidores tomados via oral, é importante seguir as indicações dadas pelo médico e continuar tomando a medicação pelo tempo prescrito. A não-adesão aos inibidores tem o potencial de fazer com que o tratamento não funcione.
Levando em consideração as possíveis preocupações do tratamento dos inibidores de tirosina quinase ao longo da vida, pesquisadores estão estudando parar os inibidores depois de um período de resposta molecular profunda.
Atualmente, há informações limitadas sobre os resultados a longo prazo dos pacientes com LMC após terem parado de tomar imatinibe. A dosagem intermitente dos inibidores é uma outra possibilidade de tratamento para reduzir os efeitos colaterais a longo prazo nos pacientes pediátricos de LMC, mas mais estudos precisam ser feitos para avaliar essa estratégia. Como não houve ensaios clínicos comparando o transplante de células-tronco e o imatinibe em crianças devido ao pequeno número de pacientes pediátricos, a decisão sobre como tratar LMC varia de caso para caso. O transplante de células-tronco deve ser avaliado devido às complicações associadas com o uso vitalício dos inibidores.
Converse com o médico do seu filho sobre o melhor tratamento para ele e discuta qualquer preocupação a respeito dos riscos das terapias. É importante que seu filho seja atendido por um médico especialista em leucemia pediátrica.
PACIENTES COM LEUCEMIA MIELOIDE CRÔNICA APRESENTAM SINTOMAS?
Diferente das outras formas de leucemia, a LMC é uma doença com progressão lenta e não interfere completamente no desenvolvimento das células normais da medula óssea (glóbulos vermelhos, glóbulos brancos e plaquetas). Portanto, pacientes podem ter LMC, mas não apresentarem sinal ou sintoma.
Aqueles que apresentam sintomas relatam sentir:
- Fraqueza
- Fadiga
- Diminuição do fôlego durante as atividades diárias
- Febre
- Dores nos ossos
- Perda de peso sem motivo aparente
- Dores abaixo da costela ou no lado esquerdo, devido ao baço aumentado
- Suor noturno
Quando os sintomas ocorrem, é porque a produção das células normais da medula óssea está comprometida pelas células da LMC. Anemia é a falta de glóbulos vermelhos, podendo causar cansaço, fadiga e diminuição do fôlego. A falta de glóbulos brancos pode aumentar a chance de ter uma infecção. A ausência de plaquetas pode levar a sangramentos ou ao aparecimento de hematomas. Os sintomas também podem acontecer porque as células da LMC se acumulam em órgãos como o baço.
QUAIS EXAMES SÃO UTILIZADOS NO DIAGNÓSTICO DA LEUCEMIA MIELOIDE CRÔNICA?
Como muitas pessoas com LMC não apresentam sintomas, o diagnóstico da Leucemia Mieloide Crônica muitas vezes acontece apenas quando, em exames de rotina, um número muito alto de glóbulos brancos são detectados no sangue.
O diagnóstico definitivo da LMC inclui estudos nas células do sangue e da medula óssea. O hematologista e o patologista são os médicos especialistas capacitados para identificar doenças, estudando as células do sangue e da medula óssea com um microscópio.
O conjunto de exames para diagnosticar a LMC é:
LEUCEMIA MIELOIDE CRÔNICA HEMOGRAMA
O Hemograma completo com contagem diferencial é usado para medir o número de glóbulos brancos, glóbulos vermelhos e plaquetas em uma amostra de sangue. Também mede a quantidade de hemoglobina dentro das células vermelhas e a porcentagem de glóbulos vermelhos na amostra. O hemograma completo deve incluir a contagem diferencial dos diferentes tipos de glóbulos brancos. Pessoas com LMC costumam ter:
- Aumento na contagem dos glóbulos brancos, muitas vezes a níveis muito altos
- Redução na contagem dos glóbulos vermelhos
- Possível redução ou aumento no número de plaquetas, dependendo da gravidade da LMC
ESFREGAÇO PERIFÉRICO
As células do sangue são colocadas em uma lâmina, tingidas e examinadas com um microscópio. Este exame mostra:
- O número, tamanho, forma e tipo das células sanguíneas
- A forma específica dos glóbulos brancos
- A proporção de células imaturas (blastos) comparadas com a proporção de células amadurecendo e glóbulos brancos totalmente maduros. Os blastos não devem estar presentes no sangue de pessoas saudáveis.
ASPIRADO E BIÓPSIA DA MEDULA ÓSSEA
Esses exames são usados para examinar as células da medula óssea em busca de anormalidades. Normalmente a coleta dos dois exames é feita ao mesmo tempo. O hematologista faz uma anestesia local no osso do quadril do paciente para que ele não sinta dor. Para fazer a aspiração da medula óssea (mielograma), uma agulha oca é inserida no osso do quadril até a medula óssea e coleta-se uma amostra de sangue com as células. Para a biópsia da medula óssea, uma agulha mais larga é usada para remover um pequeno pedaço de osso que contenha medula óssea. Ambas as amostras são examinadas em um microscópio para procurar células doentes.
ANÁLISE CITOGENÉTICA
Citogenética é o estudo dos cromossomos e suas possíveis anormalidades. Amostras da medula óssea são examinados em um microscópio para encontrar mutações cromossômicas como as do cromossomo Philadelphia (Ph). A presença do cromossomo Ph na medula óssea, juntamente com o aumento da contagem dos glóbulos brancos e outros achados característicos do hemograma e da medula óssea confirmam o diagnóstico de LMC. Como já comentado, uma pequena porcentagem das pessoas que tem LMC não apresentam o cromossomo Ph detectável por citogenética, mas quase sempre eles têm um teste positivo para a fusão do gene BCR-ABL no cromossomo 22 por meio de outros tipos de exames.
EXAME FISH (HIBRIDIZAÇÃO IN SITU FLUORESCENTE)
FISH é um exame laboratorial usado para examinar genes e cromossomos nas células. O FISH é um método mais sensível para detectar o cromossomo Ph do que testes normais de citogenética e pode identificar a presença do gene BCR-ABL (veja figura 4). No caso da LMC, o FISH usa sondas de cor que se ligam a segmentos específicos do DNA dos genes BCR e ABL nos cromossomos. Os genes BCR e ABL são marcados com diferentes substâncias químicas, cada uma das quais libera uma cor diferente, permitindo sua identificação. A cor aparece no cromossomo que contém o gene, isto é, no cromossomo 9 para ABL e no cromossomo 22 para BCR e, portanto, pode detectar o pedaço do cromossomo 9 que se moveu para o cromossomo 22 nas células de LMC. A fusão do gene BCR-ABL é mostrada pela sobreposição de cores nas duas sondas. A figura abaixo mostra o momento em que o Gene BCR-ABL está sendo identificado nas células, usando o FISH.
PCR – REAÇÃO EM CADEIA DA POLIMERASE QUANTITATIVA
O que é PCR?
Exame PCR é o teste mais sensível para detectar e medir a quantidade de genes BCR-ABL na amostra de sangue ou de medula óssea. Pode detectar quantidades muito pequenas do gene BCR-ABL, mesmo quando o cromossomo Ph não pode ser detectado pelo teste de citogenética. O nível de sensibilidade deste exame é alto, uma vez que pode detectar uma célula de LMC em uma quantidade de 100.000 a 1.000.000 de células normais. A contagem das células do sangue, exames de medula óssea, FISH e PCR exame também podem ser usados para medir como a pessoa está reagindo ao tratamento depois que ele já tiver começado. É recomendado fazer o exame de sangue PCR a cada 3 meses durante os primeiros 2 anos de tratamento. Depois de 2 anos, se o paciente estiver reagindo bem, o teste deve ser feito a cada 6 meses.
Análise da mutação do gene BCR-ABL
Algumas
vezes, ocorrem mutações no gene BCR-ABL que produz a proteína BCR-ABL.
Essas mutações alteram a forma da proteína BCR-ABL, podendo afetar como
os inibidores de tirosina quinase ligam-se à proteína BCR-ABL para
bloquear os sinais de crescimento.
A análise da mutação genética BCR-ABL é um teste que procura por
mutações nesse gene que podem fazer com que certos inibidores de
tirosina quinase parem de funcionar.
O teste da mutação do gene BCR-ABL deve ser realizado em caso de:
- Resposta inadequada a terapia inicial com inibidores de tirosina quinase
- Falha em cumprir a meta do tratamento
- Perda de resposta hematológica, citogenética, aumento de 1 log nos níveis de BCR-ABL ou a perda da resposta molecular maior
- Progressão para a fase acelerada ou blástica
- Uma análise de mutação não precisa ser feita em pacientes que estejam trocando de medicamento devido a efeitos colaterais.
https://www.abrale.org.br/


obs. conteúdo meramente informativo procure seu médico
abs






%20suicidio.jpg)




Nenhum comentário:
Postar um comentário
Vc é muito importante para mim, gostaria muito de saber quem é vc, e sua opinião sobre o meu blog,
bjs, Carla