A quimioterapia normalmente é usada em pacientes de LMC que se encontram na fase blástica como uma forma de fazer a Leucemia Mielóide Crônica regredir à fase crônica. Às vezes, altas doses de quimioterapia são ministradas para preparar o paciente para um transplante alogênico de células-tronco.
O que é Imunoterapia?
A imunoterapia é um tipo de medicamento que estimula o sistema imunológico.
INTERFERON PARA QUE SERVE
O interferon é uma substância produzida naturalmente pelo sistema imunológico, mas também pode ser fabricada em laboratório. Ele reduz o crescimento e a divisão das células do câncer. Antes da introdução dos inibidores da tirosina quinase, o interferon era considerado tratamento de primeira linha para pacientes que não podiam receber o transplante alogênico de células-tronco.
Atualmente, essa terapia é menos usada para tratar LMC porque os inibidores da tirosina quinase são mais eficientes e causam menos efeitos colaterais. O interferon pode ser uma opção para alguns pacientes que não conseguem tolerar os efeitos colaterais dos inibidores ou mulheres grávidas.
EFEITOS COLATERAIS DO INTERFERON
O interferon pode causar efeitos colaterais significativos como:
– Problemas de concentração e memória
– Mudanças de humor
– Sintomas parecidos com gripe como dores no músculo, fadiga, febre, dor de cabeça, náusea, vômito e arrepios
– Baixa contagem de glóbulos brancos, vermelhos e plaquetas
Esses efeitos colaterais continuarão enquanto o paciente usar esse medicamento, mas com o tempo, podem ficar mais fáceis de serem tolerados.
Muitos pacientes, entretanto, não conseguem lidar com esses efeitos colaterais todo dia e precisam descontinuar o tratamento.
Transplante de células-tronco hematopoiéticas (TCTH)
O transplante alogênico de células tronco
(infusão de células-tronco de um doador em um paciente) é uma opção para
alguns pacientes de LMC. É o tratamento curativo para eles. Esse tipo
de transplante, entretanto, pode causar sérios, ou até fatais,
complicações e efeitos colaterais, e normalmente não é uma boa opção para pacientes mais velhos ou pacientes com outros problemas de saúde. Os resultados são muito semelhantes se o doador compatível for um parente ou uma
pessoa sem parentesco.
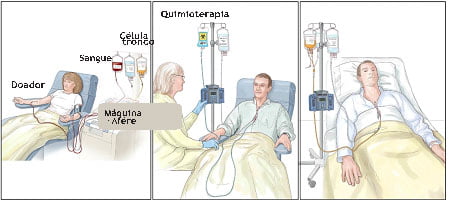
Foto 1: Células-tronco são coletadas do doador
Foto 2: Paciente recebe tratamento quimioterápico para destruir as células doentes
Foto 3: Paciente recebe as células-tronco do doador
A opção pelo transplante alogênico é cada vez mais rara porque muitos pacientes têm uma resposta muito boa aos inibidores de tirosina quinase, controlando a doença por um longo período e preservando a qualidade de vida sem os sérios riscos do transplante.
O médico irá considerar muitos fatores importantes ao decidir se o transplante alogênico é a melhor escolha de tratamento para um paciente. Esses fatores incluem a idade do paciente, saúde em geral, a fase da LMC, a resposta a outros tratamentos e a disponibilidade de um doador compatível. O transplante é considerado no caso de pacientes que tenham resistência a, pelo menos, dois tipos de inibidores de tirosina quinase; para pacientes que a LMC esteja na fase acelerada ou blástica e para pacientes que sejam intolerantes a todos os tipos de inibidores de tirosina quinase.
O fator prognóstico mais importante para a sobrevida após o transplante é a fase da LMC. Aproximadamente 90% dos pacientes com LMC crônica estarão livres da doença por 5 anos. Já os pacientes com LMC acelerada, de 40 a 50% deles estarão livres da doença após 5 anos e, apenas 10 a 20% dos pacientes com LMC blástica estarão livres da doença após 5 anos.
Cada fase da LMC requer um tipo diferente de tratamento.
A terapia com inibidores da tirosina quinase é padrão para a LMC na fase crônica pois a resposta ao tratamento é boa por longos períodos de tempo.
Hoje, são três tipos de inibidores da tirosina quinase estão aprovados no Brasil para o tratamento de primeira linha para LMC fase crônica. Eles são:
– Imatinibe 400 mg uma vez ao dia
– Dasatinibe 100 mg uma vez ao dia
– Nilotinibe 300 mg duas vezes ao dia
Ao escolher um inibidor de primeira linha, os médicos devem considerar fatores como condições de saúde pré-existentes, idade, pontuação de risco, cronograma de dose e custo. Depois de iniciada a terapia, o médico irá monitorar o paciente para determinar quão bem ele está respondendo ao tratamento. Um paciente que estiver respondendo bem, continuará com o seu tratamento atual. Se o paciente não estiver correspondendo às expectativas, o médico precisará descobrir o porquê.
Uma análise de mutação genética deve ser realizada para investigar as mutações no gene BCR-ABL. O médico também analisará se o paciente está ou não aderindo ao plano de tratamento. Se o tratamento atual não estiver funcionando, existem várias outras opções. Elas incluem:
– Alertar aos pacientes que não estão tomando a medicação como prescrita sobre a importância da adesão consciente ao tratamento
– Aumentar a dose do medicamento (se possível)
-Trocar por outro inibidor da tirosina quinase. Por exemplo, mudar o imatinibe pelo dasatinibe ou nilotinibe. Ou trocar por um dos novos medicamentos aprovados no país: asciminib, bosutimibe e ponatinibe, caso os medicamentos de primeira linha não estejam respondendo.
– Tentar quimioterapia
– Avaliar se o transplante alogênico de células-tronco é uma opção
Se a LMC passar da fase crônica para a fase acelerada durante o tratamento com a terapia de inibidor da tirosina quinase, o paciente pode tentar aumentar a dose inicial (se possível) ou trocar por outro inibidor que ainda não tenha sido tentado. Outras opções incluem:
– O inibidor ponatinibe para pacientes que não tenham respondido a dois ou mais inibidores e que tenham a mutação T315I
– O bosatinibe também é indicado para o tratamento de pacientes adultos com leucemia mieloide crônica
(LMC) positiva para o cromossomo Filadélfia (Ph+) em fase acelerada, com resistência ou intolerância à terapia anterior
– Transplante alogênico de células-tronco
Outra opção para pacientes com LMC acelerada é se submeter a um tratamento experimental, em estudo clínico – uma pesquisa feita por médicos para avaliar novos medicamentos ou novos usos para medicamentos já aprovados para outros casos. Estudos clínicos são um meio do paciente conseguir o mais novo tratamento para câncer. O objetivo da pesquisa clínica para LMC é melhorar o tratamento, melhorar a qualidade de vida e achar a cura.
Os pacientes devem discutir com o médico os possíveis benefícios e riscos de participar em um ensaio clínico.
Sobre o tratamento da fase blástica da LMC
Pacientes com LMC blástica têm um número maior de blastos. A doença na fase blástica age como uma leucemia aguda,
com uma contagem de células do sangue mais alta e sintomas mais graves.
É recomendado que o paciente se trate em um local especializado, com médicos que tenham expertise com pacientes de LMC em fase blástica.
É preciso fazer dois importantes testes antes de iniciar o
tratamento para a LMC blástica. O primeiro teste determina se a fase
blástica envolve blastos mieloides ou linfoides. Esse exame é necessário
porque o tipo de célula define o tratamento. O segundo teste, uma análise da mutação do gene BCR-ABL, procura por mutações na parte BCR-ABL do gene que produz a proteína BCR-ABL.
Diferentes mutações podem fazer a proteína BCR-ABL mais ou menos resistente aos inibidores de tirosina quinase. Uma opção para os pacientes com LMC blástica é receber o tratamento com o bosutinibe. Este inibidor da tirosina quinas é indicado para pacientes que com resistência ou intolerância à terapia anterior.
Outra opção de tratamento é receber os inibidores de tirosina quinase, com ou sem quimioterapia, e depois fazer o transplante alogênico de células-tronco. No geral, na fase blástica da LMC é preferível usar inibidores de segunda geração porque são mais potentes.
Mesmo respondendo à essa terapia, os pacientes podem precisar do transplante alogênico de células-tronco. O resultado do transplante alogênico de células-tronco tem mais chance de ser bem-sucedido quando se consegue regredir da fase blástica para a fase crônica antes do transplante.
INDICE DE RESPOSTA
MEDINDO A RESPOSTA AO TRATAMENTO DA LMC
Após o início do tratamento o seu médico irá pedir, periodicamente, exames de sangue e medula óssea para determinar a sua resposta ao tratamento. Monitorar essa resposta é uma das estratégias chaves para administrar a LMC. Em geral, quanto melhor a resposta ao medicamento, mais tempo a doença ficará controlada.
A tabela 2 mostra os diferentes tipos de respostas ao tratamento.
Existem três tipos de respostas: hematológica, citogenética e molecular.
RESPOSTA HEMATOLÓGICA
Essa resposta é classificada como “parcial” ou “completa” dependendo dos resultados dos hemogramas. Esse exame mede a quantidade de glóbulos brancos, glóbulos vermelhos e plaquetas no sangue.
Resposta hematológica parcial
Os valores de cada tipo de células do sangue começam a voltar ao normal.
Resposta hematológica completa
Os valores das células do sangue voltam ao normal.
A maioria dos pacientes sob tratamento com os inibidores de tirosina quinase tem uma resposta hematológica completa dentro de três meses desde o começo do tratamento.
RESPOSTA CITOGENÉTICA
Avalia o número de células na medula óssea que contém o cromossomo Ph. Tanto o teste citogenético quanto o FISH podem ser usados para fazer essa medição.
Resposta citogenética completa
Nenhuma célula com o cromossomo Ph é detectada na medula óssea
Resposta citogenética parcial
O cromossomo Ph é achado em 1 a 35% das células
Resposta citogenética maior
O cromossomo Ph é achado em mais de 35% das células da medula óssea.
A citogenética da medula óssea é avaliada na consulta de acompanhamento de 3 e de 6 meses para verificar a resposta do paciente ao tratamento se o PCR não estiver disponível.
RESPOSTA MOLECULAR
A resposta molecular avalia a diminuição na quantidade de células com o gene BCR-ABL. O teste PCR conta o número de células no sangue periférico que contém o gene BCR-ABL. A resposta molecular inicial do paciente ao tratamento é importante para prever o resultado e para determinar as futuras opções de tratamento.
Resposta molecular precoce
Quando o nível do gene BCR-ABL é menor do que 10% no 3º e no 6º mês após o início do tratamento; significa que menos de 10% das células (10 a cada 100 células) têm o gene BCR-ABL.
Resposta molecular maior
Quando o nível do gene BCR-ABL é menor do que 0,1%; significa que 1 a cada 1.000 células têm o gene BCR-ABL, conhecido como “redução de 3 logs”.
Resposta molecular completa
Quando nenhuma célula tem o gene BCRABL, também conhecido como “resposta molecular profunda”.
ESCALA INTERNACIONAL, MEDIÇÃO DE TESTE DE PCR
É uma escala padrão para medir os resultados do teste PCR, isto é, medir o número de células que têm o gene BCR-ABL e determinar quão bem o tratamento está funcionando. A Escala Internacional define a linha de base padrão como BCR-ABL 100%. Uma redução de log indica que o nível de BCR-ABL diminuiu uma certa quantidade a partir da linha de base padrão.
– Redução de 1 log indica que o nível do BCR-ABL diminuiu 10 vezes abaixo da linha de base padrão. Isso significa que 10% das células (10 a cada 100 células) têm o gene BCR-ABL, também conhecido como “BCR-ABL 10%”. Essa redução é equivalente a resposta molecular precoce.
– Redução de 2 log significa que o nível de BCR-ABL diminui 100 vezes abaixo da linha padrão. Isso significa que 1% das células (1 a cada 100 células) têm o gene BCR-ABL, também conhecido como “BCR-ABL 1%”.
– Redução de 3 log significa que BCR-ABL diminuiu 1.000 vezes abaixo da linha padrão. Isso significa que 0,1% das células (1 a cada 1.000 células) têm o gene BCR-ABL, também conhecido como “resposta molecular maior”.
– Redução de 4,5 log significa que 0,0032% das células tem o gene BCR-ABL. Redução de 4,5 log é chamado de “resposta molecular completa” ou “resposta molecular profunda”. Alcançar a resposta molecular profunda é um sinal de que a doença está em remissão. Pacientes que alcançam e mantêm a resposta molecular profunda por um período significativo de tempo podem ser considerados como candidatos para descontinuar o medicamento em um estudo clínico.
O teste de PCR pode não estar padronizado entre os laboratórios, uma vez que estes estabelecem seus próprios padrões. Consequentemente, uma mesma amostra pode apresentar resultados diferentes se analisada em laboratórios distintos. Assim, para obter resultados mais consistentes, é melhor fazer os testes sempre no mesmo lugar. Isso ajudará os pacientes e a sua equipe de saúde a monitorarem com mais eficácia as respostas ao tratamento. É recomendado realizar o teste de PCR a cada três meses nos dois primeiros anos. Após dois anos, se o paciente estiver apresentando uma resposta ao tratamento satisfatória, o teste poderá ser feito a cada três ou seis meses.
| Tipo de resposta | Fatores | Testes usados para medir a resposta |
|---|---|---|
| Hematológica (resposta hematológica completa) | Contagem de glóbulos sanguíneos voltam ao normal. Nenhum blasto no sangue periférico. Nenhum sinal ou sintonia da doença. Baço volta ao tamanho normal. |
Hemograma completo com diferencial |
| Citogenética Resposta citogenética completa Resposta citogenética parcial Resposta citogenética maior Resposta citogenética menor |
Cromossomo Ph não detectado 1% a 35% das células tem cromossomo Ph 0% a 35% das células tem cromossomo Ph Mais de 35% das células tem cromossomo Ph |
Citogenética da medula óssea ou FISH |
PESQUISA E ESTUDO CLÍNICO
PESQUISA E ESTUDO CLÍNICO
O que é Estudo Clínico?
São estudos que testam novos medicamentos e tratamentos antes de eles serem aprovados pelas agências regulatórias como tratamento padrão. Os pacientes com LMC podem participar de estudos clínicos.
Todo novo medicamento ou regime de tratamento passa por uma série de testes chamados “estudos clínicos” antes de começarem a fazer parte da terapia padrão. Os estudos clínicos são cuidadosamente montados e revisados por clínicos especialistas e pesquisadores para garantir tanta segurança e precisão científica quanto possível. Participação em um estudo clínico cuidadosamente conduzido pode ser a melhor opção de tratamento disponível. A participação de pacientes em estudos clínicos feitos no passado resultou em terapias usadas hoje em dia.
Estudos clínicos são desenhados para serem precisos e muito seguros. Existem estudos clínicos para pacientes recém-diagnosticados, para pacientes com LMC em fase avançada, e para pacientes que são intolerantes ou que tenham resistência ao seu medicamento atual. Às vezes, o estudo clínico é uma grande promessa para aumentar as taxas de remissão da LMC e para achar a cura.
ABORDAGENS DE PESQUISA
Os objetivos atuais das pesquisas com LMC são para:
- Desenvolver terapias verdadeiramente curativas
- Terapias que funcionem quando outras não tiverem dado certo
- Diminuir os efeitos colaterais do tratamento
As seguintes abordagens estão sob estudo clínico para o tratamento de pacientes de LMC.
MELHORAR OS TRATAMENTOS ATUAIS
Apesar dos ótimos resultados da terapia com os inibidores na LMC crônica, muitos estudos estão buscando um resultado ainda melhor. A pesquisa inclui:
- Determinar quais pacientes devem receber quais tipos de inibidores de tirosina quinase como terapia inicial
- Estabelecer qual é o melhor momento para trocar o tratamento inicial para o de segunda linha
- Descobrir se as respostas profundas são alcançadas quando outros agentes são adicionados aos inibidores
- Prevenir e/ou prever efeitos colaterais a longo prazo dos inibidores
Determinar quais pacientes podem, com sucesso, descontinuar os inibidores
TERAPIAS COM NOVAS DROGAS
Os inibidores de tirosina quinase tratam a LMC ao atacar a proteína BCR-ABL que coordena o crescimento das células de leucemia. É comum, entretanto, os pacientes de LMC não responderem total ou parcialmente ou tornarem-se resistentes a esses medicamentos. ABL001 é um medicamento experimental projetado para desativar a proteína BCR-ABL. Atualmente, os tratamentos com inibidores atacam a proteína BCR-ABL, mas o ABL001 tem como alvo um lugar diferente da proteína. Pesquisadores também estão estudando o medicamento rebastinibe.
Rebastinibe é um novo inibidor que também é desenvolvido para superar a resistência ao imatinibe, ligando-se a um local diferente da proteína BCR-ABL. Rebastinibe pode funcionar contra mutações, incluindo a T315I.
ESTRATÉGIAS DE ERRADICAÇÃO DA DOENÇA
Mesmo depois de parecer que a LMC foi tratada com sucesso, um número muito pequeno de células-tronco da leucemia pode continuar no sangue e na medula óssea do paciente. Essa condição é chamada de “doença residual mínima”. Essas células-tronco parecem ser resistentes à terapia com os inibidores. Isto levou a criação de estratégias destinadas a direcionar as vias de sinalização de células-tronco que estão envolvidas na sobrevida das células. Pesquisadores estão tentando obter uma melhor compreensão dos mecanismos que levam à sobrevida das células tronco leucêmicas de LMC.
Uma das áreas de pesquisa envolve inibidores de uma proteína chamada “smoothened” (SMO). É esperado que os inibidores tenham como alvo a proteína SMO achada nas células-tronco da LMC enquanto poupam as células saudáveis do sangue. Alguns outros caminhos são estudados e existem esforços contínuos para avaliar a sua importância para pacientes com LMC.
ESTUDOS DE DESCONTINUAÇÃO DOS INIBIDORES DE TIROSINA QUINASE
O tratamento da LMC com os inibidores tem avançado a um ponto onde muito pacientes alcançam níveis muito baixos ou indetectáveis do gene BCR-ABL no sangue. Pesquisadores estão estudando se alguns pacientes com resposta molecular profunda podem, com segurança, descontinuar o tratamento e ter uma remissão. Em um estudo clínico, aproximadamente 40% dos pacientes que alcançaram uma resposta molecular completa por pelo menos 2 anos estavam aptos a parar o tratamento com os inibidores sem uma recaída. Além disso, aqueles que tiveram uma recaída conseguiram restaurar a remissão ao retomar a sua terapia com os inibidores. Atualmente, descontinuar a terapia dos inibidores deve ser feita apenas dentro de estudos clínicos.
TERAPIA DE VACINA
Várias formas de terapia com vacinas são estudadas para verificar se elas podem reduzir ou eliminar as células de leucemia remanescentes no paciente com LMC. Os inibidores de tirosina quinase destroem a maioria das células leucêmicas no corpo, mas, na maioria dos pacientes, algumas células cancerosas ainda permanecem. Essas células podem causar uma recaída, especialmente se a terapia dos inibidores for parada. Pesquisadores tentam achar maneiras de ajudar o sistema imunológico a reconhecer a diferença entre as células normais e as de LMC para que o organismo possa atacar as células que restaram após os inibidores de tirosina quinase.
TRANSPLANTE DE CÉLULAS-TRONCO COM INTENSIDADE REDUZIDA
Uma forma modificada do transplante alogênico é conhecido como transplante alogênico de células-tronco com “intensidade reduzida” ou “não mieloablativo”. Ele pode ser uma opção para pacientes que não responderam aos outros tratamentos. Um paciente que está sendo preparado para um transplante de intensidade reduzida recebe doses menores de quimioterapia e/ou radioterapia na preparação para o transplante, comparado com as doses dadas aos pacientes que fazem o transplante alogênico comum. Os medicamentos imunossupressores são usados para prevenir que o corpo do paciente rejeite a doação das células-tronco do doador. As células do sistema imunológico do doador podem atacar as células da LMC do paciente (chamado “efeito transplante versus tumor”).
A teoria que é testada com o transplante de intensidade reduzida é que ao realizar procedimentos menos tóxicos antes do transplante, o corpo fica mais apto a resistir ao transplante, porém ainda com o efeito desejado “transplante versus tumor”.
Outros medicamentos estão sendo testados em estudos clínicos para aumentar o efeito enxerto versus leucemia do transplante de células-tronco e reduzir os riscos de doença do enxerto contra o hospedeiro.
| Tipo de resposta | Fatores | Testes usados para medir a resposta |
|---|---|---|
| Hematológica (resposta hematológica completa) | Contagem de glóbulos sanguíneos voltam ao normal. Nenhum blasto no sangue periférico. Nenhum sinal ou sintonia da doença. Baço volta ao tamanho normal. |
Hemograma completo com diferencial |
| Citogenética Resposta citogenética completa Resposta citogenética parcial Resposta citogenética maior Resposta citogenética menor |
Cromossomo Ph não detectado 1% a 35% das células tem cromossomo Ph 0% a 35% das células tem cromossomo Ph Mais de 35% das células tem cromossomo Ph |
Citogenética da medula óssea ou FISH |
O CROMOSSOMO FILADÉLFIA E O GENE DE FUSÃO BCR-ABL:
O QUE É BCR-ABL
Um cromossomo é um grupo organizado de DNA, substância encontrada no núcleo de cada célula e que contém as instruções genéticas que coordenam o seu desenvolvimento e funcionamento. Uma célula humana, normalmente, possui 23 pares de cromossomos, totalizando 46 cromossomos: cada par é diferente do outro e é identificado numericamente. Cada par de cromossomo é composto de um cromossomo vindo da mãe e outro vindo do pai. Vinte e dois desses pares são chamados de autossomos, e são iguais tanto em homens quanto em mulheres. O 23º par é o chamado cromossomo sexual e é diferente em homens e mulheres. O par nos homens é feito a partir de um cromossomo X e um cromossomo Y, enquanto o par nas mulheres é feito a partir de dois cromossomos X.
BCR-ABL significado
Todos os casos de LMC são causados pela fusão dos genes BCR-ABL. O gene ABL (Abelson Leukemia Gene, nomeado a partir de Herbert Abelson, o cientista que descobriu esse gene) está localizado no cromossomo 9 e o gene BCR (“breakpoint cluster region” em inglês = região de ponto de quebra) no cromossomo 22. O gene BCR-ABL é formado durante uma divisão celular dentro da medula óssea devido a uma translocação entre os cromossomos 9 e 22. Na translocação ocorre quebra dos cromossomos e os pedaços quebrados se juntam (rearranjo) de forma errada.
O QUE É CROMOSSOMO FILADÉLFIA
No caso da LMC ocorre quebra errada no cromossomo 9, junto com a quebra errada no cromossomo 22. Quando os pedaços quebrados que tem o gene BCR e o gene ABL desses cromossomos se juntam, formam o gene BCR-ABL no chamado cromossomo Philadelphia (tem este nome porque foi descoberto no Instituto Winstar na Philadelphia). “Ph” é a abreviação para o cromossomo Philadelphia.
A abreviação Ph com o sinal positivo + (Ph+) indica que a pessoa tem o cromossomo Ph anormal. A abreviação Ph junto com o sinal negativo – (Ph) indica que a pessoa não tem o cromossomo Ph (veja a figura 2).
Cromossomos Celulares da Medula.
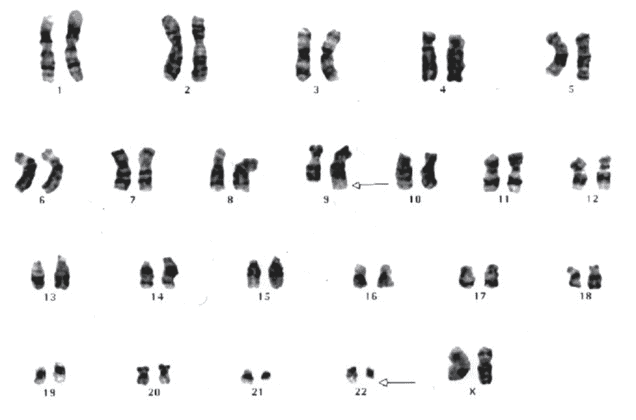
Conjunto de cromossomos de uma célula-tronco de uma mulher paciente de LMC.
Quanto maior a numeração do cromossomo, menor ele é. A seta na quarta coluna indica o cromossomo 22 com um dos braços encurtados (o chamado cromossomo Philadelphia), característicos das células da medula dos pacientes com LMC. A seta na segunda fileira indica o braço do cromossomo 9 que foi alongado. Essas duas mudanças refletem a translocação do material cromossômico entre os cromossomos 9 e 22.
Evento Causador de Leucemia Mieloide Crônica
Como o gene causador de câncer BCR-ABL (Oncogene) é formado:
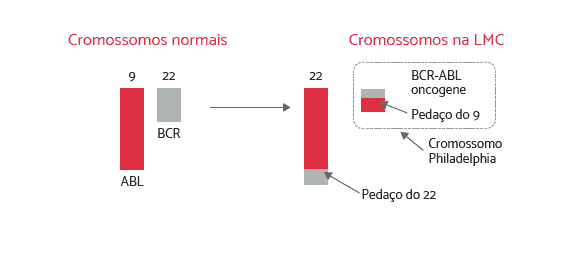
Evento Causador de Leucemia Mieloide Crônica
Formação do gene BCR-ABL causador da LMC (Oncogene)
A parte do gene ABL do cromossomo 9 se transloca e se funde com a parte restante da porção do gene BCR do cromossomo 22. A parte translocada do cromossomo 9 resulta em uma fusão chamada BCR-ABL. A fusão do gene BCR-ABL dá início à produção de uma proteína anormal (mutante), uma enzima chamada BCR-ABL tirosina quinase. A presença dessa proteína enzimática anormal é que causa a mutação na célula-tronco, transformando-a em uma célula de leucemia.
O gene anormal BCR-ABL estimula as células a produzirem uma proteína anormal chamada “BCR-ABL tirosina quinase”. Essa proteína manda sinais para as células dizendo para elas crescerem e se dividirem, sinalizando para as células-tronco do sangue produzirem muitos granulócitos (glóbulos brancos).
Esses granulócitos específicos com o gene BCR-ABL são chamados de “células leucêmicas” ou “células da LMC”. Os granulócitos não são normais e não se tornarão glóbulos brancos saudáveis. Eles produzem novas células muito rápido e não morrem quando deveriam. Eventualmente, os granulócitos se agrupam na medula óssea e eliminam os glóbulos vermelhos, glóbulos brancos e plaquetas saudáveis. Quando isso acontece, podem ocorrer anemia, infecções ou hemorragias.
Mais de 95% dos pacientes com LMC tem o cromossomo Philadelphia. São pacientes que apresentam LMC Ph+. Entretanto, um número muito pequeno de pacientes tem o gene BCR-ABL, porém o cromossomo Philadelphia é indetectável. Neste caso eles apresentam Ph-negativo (Ph-). Pacientes com LMC Ph- que têm o gene BCR-ABL rearranjado tem o mesmo tratamento que os pacientes Ph+.
Alguns pacientes podem ter um tipo de leucemia em que muitos granulócitos são fabricados na medula óssea, mas são Ph- e não têm o gene BCR-ABL. Esses pacientes são diagnosticados como tendo “LMC atípica”, e podem ter outros oncogenes desconhecidos causando a doença. Geralmente, nesse caso, eles respondem menos ao tratamento e têm menor sobrevida.
FONTE :https://abrale.org.br/doencas/leucemia/lmc/
obs. conteúdo meramente informativo procure seu médico
abs
Carla


%20suicidio.jpg)




Nenhum comentário:
Postar um comentário
Vc é muito importante para mim, gostaria muito de saber quem é vc, e sua opinião sobre o meu blog,
bjs, Carla