O QUE É LEUCEMIA LINFOIDE AGUDA?
De acordo com o INCA (Instituto Nacional do Câncer) estima-se, para o ano de 2019, 10.800 casos novos de leucemia no Brasil. Como a LLA representa cerca de 12% das leucemias no adulto, pode-se estimar 13.000 casos novos de LLA por ano no país.
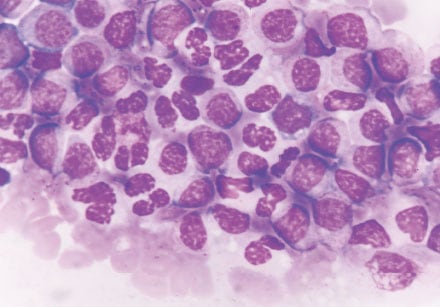
Em uma medula saudável, as células-tronco tornam-se maduras e adultas por meio do processo chamado “diferenciação”. Na leucemia linfoide aguda (LLA) surge um linfócito imaturo e danificado na medula óssea, devido a um erro em seu material genético (DNA). Esses erros genéticos podem dar origem a uma célula blástica leucêmica (linfoblasto ou blasto leucêmico) que fica parada nos primeiros estágios do desenvolvimento celular. A célula blástica imatura não amadurece e não se transforma em uma célula sanguínea funcional.
Os erros genéticos fazem com que a célula mutante cresça e se divida continuamente, ao passo que uma célula saudável, cessa de se dividir e acaba morrendo. Cada linfoblasto que surge, depois do aparecimento da leucemia, tem o DNA mutante e se multiplica incontrolavelmente. Os blastos leucêmicos rapidamente se acumulam na medula óssea, suprimindo o desenvolvimento de células sanguíneas normais e saudáveis. Como resultado, há um acúmulo de linfoblastos que não funcionam e poucas células sanguíneas maduras.
O que os estudos atuais revelam sobre “o que é LLA”?

Recentemente, o professor Mel Greaves, do Instituto de Pesquisa do Câncer de Londres, publicou um estudo sobre o desenvolvimento da LLA na infância, no qual defende a hipótese de que seriam necessários dois erros genéticos (mutações) para o surgimento da Leucemia Linfóide Aguda. A primeira ocorreria antes do nascimento (vida intrauterina) e a segunda seria desencadeada por um desarranjo do sistema imunológico após exposição a infecções durante a infância.
O professor ainda informa que as infecções e estímulos antigênicos ao sistema imunológico durante o primeiro ano de vida poderiam ser benéficos nos processos de seleção e maturação dos precursores linfoides e, assim, reduziriam o risco da segunda mutação e por consequência do surgimento da LLA. No momento em que LLA é diagnosticada, o número de células sanguíneas saudáveis (glóbulos vermelhos, glóbulos brancos e plaquetas) é geralmente menor do que o normal. Isso pode resultar em infecções, anemia e sangramento excessivo.
TERMO MÉDICO E O QUE REPRESENTA:
- Número baixo de glóbulos vermelho: Anemia
- Número baixo de plaquetas: Trombocitopenia (trombócito é outro nome para plaqueta)
- Baixo número de neutrófilos: Neutropenia (neutrófilo é um tipo de glóbulo branco)
Primeiro precisamos entender o que são Sinais e Sintomas:
Sinais e sintomas são mudanças no corpo que podem indicar doença. Sinal é alguma alteração que o médico vê durante um exame no consultório ou em um resultado de exame de laboratório. Sintoma é uma mudança que o paciente pode ver e/ou sentir.
Uma pessoa que apresenta sinais ou sintomas que sugerem a possibilidade de leucemia é geralmente encaminhada a um especialista. Este especialista é o onco-hematologista, médico especializado no diagnóstico e tratamento de cânceres do sangue, como leucemia, linfoma e mieloma múltiplo.
O que podemos citar como sintomas de LLA?
Os sinais e sintomas da LLA também estão associados a várias outras doenças menos graves. É comum alguém com este tipo de leucemia sentir uma perda de bem-estar devido à diminuição da produção de células sanguíneas normais na medula óssea. Consequentemente, os pacientes com LLA não possuem um número suficiente de glóbulos vermelhos, glóbulos brancos e plaquetas maduros.
Os sintomas que uma pessoa com baixa contagem de glóbulos vermelhos (anemia) apresenta, incluem:
- Fadiga
- Falta de ar durante atividades físicas normais
- Tonturas ou desmaios
- Pele Pálida
Os sintomas ocasionados pela baixa de glóbulos brancos (leucopenia) são:
- Infecções frequentes
- Febre
Os sintomas ocasionados pela baixa de glóbulos brancos (leucopenia) são:
- Sangramento prolongado nos pequenos cortes
- Pintinhas vermelhas na pele, chamadas “petéquias”
- Hemorragia nasal frequente ou grave
- Sangramento nas gengivas
- Sangue na urina
Outros sintomas gerais de LLA incluem:
- Desconforto nos ossos ou articulações
- Baço, fígado ou gânglios linfáticos aumentados
- Dor ou sensação de plenitude abaixo das costelas
- Perda de peso inexplicável ou perda de apetite
Como diagnosticar a Leucemia Linfoide Aguda?
Realizar o exato diagnóstico do tipo de leucemia é importante para que o médico possa:
- Estimar como a doença está avançando
- Determinar o tratamento mais adequado
Por isso, fazer exames é essencial para o diagnóstico correto.
Converse com seu médico sobre:
- Os exames que você vai realizar
- O que os resultados dos exames significam
- Como ter cópias dos resultados dos exames
Histórico médico e exame físico
Se uma pessoa apresentar sinais ou sintomas de leucemia, o médico irá montar um histórico médico completo. Esse histórico pode incluir informações sobre doenças, lesões, tratamentos e medicamentos no passado. Algumas doenças estão relacionadas ao histórico familiar, por isso o médico também pode perguntar sobre a saúde dos parentes de sangue do paciente. O médico também vai investigar os sintomas atuais e realizar um exame físico.
Durante o exame, o médico pode ouvir os pulmões e o coração e examinar cuidadosamente o corpo em busca de sinais de infecção e doença. Para verificar os órgãos internos, o médico também pode sentir (apalpar) diferentes partes do corpo do paciente. Por exemplo, o médico pode apalpar o abdômen para ver se estão com o fígado ou o baço aumentados. Nos homens, o médico também pode examinar os testículos para ver se há algum nódulo.
Além disso, é possível que o médico verifique sinais de infecção, como por exemplo, linfonodos aumentados. O especialista provavelmente irá apalpar áreas como axilas e pescoço para verificar se há aumento dos gânglios linfáticos. O paciente com suspeita de leucemia deve ser encaminhado para o onco-hematologista e também deve evitar o uso frequente e abusivo de corticoides (prednisona e similares) antes da confirmação diagnóstica, pois estes medicamentos podem mascarar sintomas e dificultar a detecção das células blásticas.
Exames de sangue e medula óssea
Se os sinais e sintomas sugerirem que a pessoa pode ter leucemia, o médico solicitará exames de sangue e da medula óssea. Os resultados dos exames de sangue e da medula óssea serão utilizados para confirmar o diagnóstico e determinar o tratamento.
A coleta de sangue é feita no braço do paciente. Já as amostras da medula óssea são geralmente retiradas do osso do quadril do paciente e com anestesia local. A punção da medula óssea, exame chamado de mielograma, é feita com uma agulha especial, inserida no osso do quadril até atingir a medula óssea, quando então é aspirada uma gota de sangue para examinar as células e um volume de 3-4mL para fazer a imunofenotipagem e o cariótipo. Para a biópsia da medula utiliza-se uma agulha especial, mais larga, que permite retirar uma pequena amostra da parte central do osso, que contém medula óssea. Esses dois exames são quase sempre coletados na mesma punção do osso.
No laboratório, o médico examinará as amostras de sangue e da medula óssea. O patologista é o especialista na identificação de doenças do sangue, e que estuda as células via microscópio.
Hemograma completo com diferencial
Este exame é utilizado para medir o número de glóbulos vermelhos, glóbulos brancos e plaquetas presentes em uma amostra de sangue retirada pela veia. Também mede a quantidade de hemoglobina nos glóbulos vermelhos. O exame diferencial avalia o número dos diversos tipos de glóbulos brancos na amostra.
Pessoas com LLA podem ter o número de glóbulos brancos alto, normal ou baixo e um baixo número de glóbulos vermelhos e plaquetas. Isso ocorre porque muitos linfoblastos estão sendo feitos na medula óssea, região em que aglomeram-se, impedindo que as células sanguíneas saudáveis sejam formadas. Mesmo quando o resultado de um hemograma sugere leucemia, o diagnóstico de LLA em geral somente é feito após a avaliação das células da medula óssea.
Perfil Químico Sanguíneo
Este exame de sangue mede os níveis de certas substâncias liberadas no sangue pelos órgãos e tecidos do corpo. Essas substâncias incluem eletrólitos (como sódio, potássio e cloreto), gorduras, proteínas, glicose (açúcar), ácido úrico e enzimas. Os resultados dos exames químicos sanguíneos indicam o quanto os rins, o fígado e outros órgãos do paciente estão funcionando bem. Esses resultados, embora não sejam usados para diagnosticar leucemia, podem mostrar uma quantidade anormal de uma determinada substância no sangue, podendo sugerir a doença ou algum outro problema de saúde. Um perfil bioquímico sanguíneo também fornece informações úteis sobre qualquer possível dano aos órgãos causado por células da leucemia ou pelo tratamento da LLA.
Exames de coagulação
Este exame de sangue avalia como está a coagulação do sangue e também mostra se há deficiências em algumas proteínas, como o fibrinogênio.
Avaliação das células do sangue
O sangue da veia e da medula óssea são examinados pelo hematologista ou pelo patologista por meio de um microscópio para determinar o tamanho, a forma e o tipo das células, bem como para identificar outras características celulares. Importante avaliar se as células se parecem mais com células normais e maduras ou mais com células anormais e imaturas (blastos). A porcentagem de blastos contados na amostra de sangue é muito importante.
Normalmente, não se tem blastos no sangue, e na medula óssea pode-se ter até 5% de blastos não leucêmicos. No diagnóstico de LLA tem-se mais de 20% de blastos na medula óssea, os linfoblastos.
Células de Leucemia Linfoide Aguda
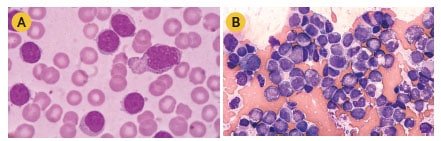
Citometria de Fluxo
É um exame que identifica as células do sangue periférico ou da medula óssea conforme as substâncias que estão em sua superfície, os chamados antígenos (marcadores/proteínas). O padrão destas proteínas de superfície é chamado de “imunofenótipo”. Para fazer a imunofenotipagem colocam-se algumas substâncias especiais na amostra do sangue ou da medula óssea. Os anticorpos têm como característica ligar-se aos antígenos. Na amostra com as células sanguíneas, cada tipo específico de anticorpo se liga às células que têm um antígeno específico que corresponde com o anticorpo. As células passam por um feixe de raios laser e aquelas com anticorpos ligados a elas emitem luz. As células da leucemia são diferentes das células saudáveis: elas podem ter antígenos diferentes em sua superfície, dependendo se as células são mieloides ou linfoides e do seu estágio de desenvolvimento.
A citometria de fluxo ajuda a confirmar o diagnóstico de LLA, bem como determina o tipo de linfócito doente (B, T ou NK) e avalia a maturidade das células. A citometria de fluxo também é usada para verificar o resultado do tratamento, por meio da determinação da doença residual mínima (DRM), que corresponde uma detecção de células leucêmicas em uma quantidade mínima na medula óssea, que apesar de ser mínima, se persistentes durante o tratamento podem possibilitar um maior risco de recaída, podendo justificar modificações da terapia.
Testes Genéticos
Usados para identificar, examinar e medir cromossomos e genes.
Análise Citogenética (Cariótipo)
Neste exame estuda-se os cromossomos dentro das células por meio de um microscópio. O cariótipo é usado para procurar alterações nos cromossomos das células de leucemia do paciente com LLA. As células humanas normais contêm 23 pares de cromossomos, somando um total de 46 cromossomos. Cada par de cromossomos tem um certo tamanho, forma e estrutura. Em muitos casos de LLA, os cromossomos das células da leucemia sofreram mudanças que podem ser vistas em microscópio, como translocações e cromossomos extras. Uma translocação ocorre quando um pedaço de um cromossomo se rompe e se liga a outro cromossomo. Às vezes, pedaços de dois cromossomos diferentes trocam de lugar. Isso resulta em um “gene de fusão” (um gene anormal que é formado quando dois genes diferentes são fundidos).
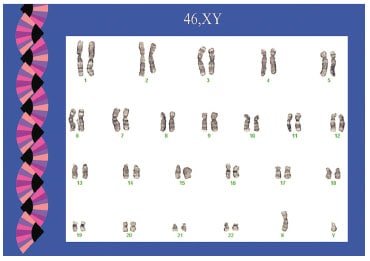
- A análise citogenética é feita no sangue da medula óssea ou no sangue periférico. As células da leucemia são preparadas para crescer no laboratório e tingidas para que se possa enxergar os cromossomos no microscópio e depois fotografar para mostrar os cromossomos (o cariótipo). O cariótipo mostrará se há alterações no tamanho, forma, estrutura ou no número de cromossomos nas células de leucemia.
A análise citogenética fornece informações que são importantes para escolher as opções de tratamento e determinar o prognóstico de um paciente. Estas informações podem fazer uma previsão de como a doença irá responder à determinada terapia. Por exemplo, uma translocação entre os cromossomos 9 e 22 está associada a um diagnóstico de LLA positivo para cromossomo Filadélfia (Ph+), um subtipo de LLA que é tratado de maneira diferente de outros subtipos.
Hibridização por Fluorescência in situ (FISH)
Esta é uma técnica usada para identificar e examinar genes ou cromossomos em células e tecidos. Nos casos da LLA, os médicos usam FISH para detectar certas alterações nos cromossomos e genes das células de leucemia. Pedaços de DNA com corantes fluorescentes especiais feitos em laboratório são adicionados às células de leucemia em uma lâmina de vidro. Quando os pedaços de DNA se ligam a genes específicos ou áreas de cromossomos na lâmina, são vistos pelo microscópio porque ficam fluorescentes. O teste FISH consegue detectar alterações que são pequenas demais para serem vistas no cariótipo. A desvantagem do FISH é que o médico tem que selecionar quais cromossomos ou genes específicos devem ser examinados antes de executar o teste.
Reação em Cadeia da Polimerase (PCR)
O PCR é uma técnica de laboratório muito sensível, utilizada para detectar e medir algumas mutações genéticas e mudanças cromossômicas pequenas demais para serem vistas no microscópio. O teste de reação em cadeia da polimerase aumenta ou “amplifica” pequenas quantidades de partes específicas de RNA (ácido ribonucleico) ou DNA para que seja mais fácil detectá-los e medi-los. Este teste pode encontrar uma única célula de leucemia entre mais de 500 mil a 1 milhão de células normais. O teste de reação em cadeia da polimerase é um método usado para determinar a quantidade de doença residual mínima (DRM), que é uma pequena quantidade de células cancerígenas que ficam no corpo após o tratamento. Esse teste pode ser feito na medula óssea ou com uma amostra de sangue.
Exame do líquido espinhal
Punção lombar
A LLA pode se espalhar para o líquido cefalorraquidiano (líquor), que é o líquido que fica ao redor do cérebro e da medula espinhal. Uma amostra deste líquido é examinada para saber se as células de leucemia se espalharam ou não nessa região. A punção lombar é o nome do procedimento usado para coletar o líquor da coluna vertebral. O primeiro passo para a realização da punção é aplicar um anestésico local na parte posterior inferior da coluna. Depois uma agulha fina é inserida entre dois ossos (vértebras) e dentro do canal medular para a retirada de uma amostra do líquor. A amostra é examinada no microscópio em busca de possíveis células de leucemia no cérebro e na medula espinhal.
Exames de imagem
Com eles, será possível analisar o interior do corpo do paciente.
Ultrassonografia
Este procedimento usa ondas sonoras de alta energia para examinar tecidos e órgãos dentro do corpo. Às vezes, a leucemia pode crescer fora da medula óssea – mais comumente nos gânglios linfáticos. O ultrassom pode ser usado para procurar linfonodos e aumento do fígado ou do baço causados por um acúmulo de células de leucemia no tórax, abdômen e pelve. A LLA também pode comprometer os testículos e o exame ultrassonográfico pode ser necessário para investigar se há algum tumor na região.
Tomografia Computadorizada (TC)
A tomografia computadorizada é feita a partir de um computador ligado a uma máquina de Raio-X, capaz de reproduzir uma série de imagens detalhadas de áreas internas do corpo. Pode ajudar na identificação de linfonodos e aumento do fígado ou baço.
Ressonância Nuclear Magnética (RNM)
Usa campos magnéticos e ondas de rádio para criar imagens dos órgãos e tecidos do corpo. As imagens de RNM podem ser usadas para ver o cérebro e a medula espinhal quando um paciente apresenta sintomas como dor de cabeça ou convulsões que sugerem que as células da LLA podem ter se espalhado para o cérebro e para a medula espinhal.
Ecocardiograma
É uma imagem do coração criada por ondas sonoras (ultrassom) pulsantes no interior dos tecidos e órgãos do tórax. O ecocardiograma mostra o tamanho, a forma e a posição do coração, bem como suas estruturas internas. Também mostra como o coração está batendo e como está bombeando sangue. Como alguns tratamentos para a LLA podem causar algum dano ao coração, o médico usa este exame para avaliar a função cardíaca e o coração do paciente, podendo decidir pelo melhor tratamento.
QUAIS SÃO OS TIPOS DE LEUCEMIA LINFOIDE AGUDA?
O diagnóstico da LLA requer a identificação de 20% ou mais de blastos leucêmicos de origem linfoide (linfoblastos) na medula óssea. Os subtipos de LLA são determinados com base nos resultados dos exames feitos em laboratório.
Subtipos de LLA
Os subtipos de LLA (L1, L2 e L3) dependem das características das células de leucemia. A identificação do subtipo é um fator importante no planejamento do tratamento, como medicamentos, as combinações e dosagens de quimioterápicos, tempo de duração e até mesmo se há ou não necessidade de um transplante de células-tronco hematopoiéticas.
Leucemia linfoide de células B / linfoma
Este subtipo de LLA começa em células imaturas que normalmente se desenvolvem em linfócitos de células B. É o subtipo mais comum. Entre as crianças, a LLA de células B representa aproximadamente 88% dos casos. Entre os adultos, representa 75% dos diagnósticos. Antes de 2008, a OMS (Organização Mundial de Saúde) classificava a leucemia linfoide de células B como “leucemia linfoblástica B precursora”, e esse termo ainda é muito usado para distingui-la da LLA de células B maduras. A LLA de células B maduras é agora chamada de “leucemia de Burkitt”. O tratamento para a leucemia de Burkitt é baseado na terapia para o linfoma não-Hodgkin e é diferente do tratamento usado para LLA. Diante dos avanços científicos ocorridos, em 2016 a OMS atualizou a classificação dos subtipos de LLA, baseando-se principalmente nas alterações citogenéticas e na biologia de cada subtipo.
Leucemia Linfoide de células T
A Leucemia Linfoide de células T. origina-se em células imaturas que normalmente se desenvolveriam em linfócitos de células T. Este subtipo é menos comum e ocorre mais frequentemente em adultos do que em crianças. Entre os adultos, a linhagem de células T representa cerca de 25% dos casos. Entre as crianças, a linhagem de células T representa aproximadamente 12% dos casos.
Alterações Citogenéticas.
Além de classificar a LLA como leucemia linfoide de células B ou T, a OMS ainda classifica a LLA de acordo com as alterações específicas em determinados cromossomos e genes. Essa identificação de anormalidades citogenéticas específicas é fundamental para a avaliação da doença, estratificação de risco e planejamento do tratamento.
Translocações são o tipo mais comum de alteração genética associada à LLA. Em uma translocação, o DNA de um cromossomo se rompe e fica ligado a um cromossomo diferente. Isso resulta em um “gene de fusão”, um gene anormal que é formado quando dois genes diferentes são fundidos.
Outro tipo de alteração genética na LLA é o resultado de anormalidades numéricas. Uma anormalidade numérica é o aumento (hiperdiploidia) ou a perda do número de cromossomos em relação aos 46 cromossomos normais. Uma mudança nestes números pode afetar o crescimento, o desenvolvimento e o funcionamento dos sistemas do corpo. Aproximadamente 25% das crianças com LLA têm hiperdiploidia.
Cerca de 75% dos casos de adultos e crianças com LLA podem ser classificados em subgrupos com base no número de cromossomos ou análise de DNA, rearranjos cromossômicos específicos e alterações genéticas moleculares. Nem todos os pacientes com LLA apresentam as mesmas alterações cromossômicas. Algumas alterações são mais comuns do que outras e algumas têm um efeito maior no prognóstico do paciente.
Anormalidade: Hiperdiploidismo (mais de 46 cromossomos)
- Alteração genética: —
- Frequência nos adultos (%): 7
- Frequência nas crianças (%): 25
- Fatores Prognósticos Associados: Favorável
Anormalidade: Cromossomo Ph
- Alteração genética: BCR-ABL1
- Frequência nos adultos (%): 25
- Frequência nas crianças (%): 2-4
- Fatores Prognósticos Associados: Favorável
Anormalidade: t(12;21)(p13;q22)
- Alteração genética: ETV6-RUNX1 (TEL-AML1)
- Frequência nos adultos (%): 2
- Frequência nas crianças (%): 22
- Fatores Prognósticos Associados: Favorável
Anormalidade: t(11;14)(q11)[eg, (p13;q11), (p15;q11)]
- Alteração genética: TCRα e TCRσ
- Frequência nos adultos (%): 20-25
- Frequência nas crianças (%): 10-20
- Fatores Prognósticos Associados: —
Anormalidade: BCR-ABL1-like
- Alteração genética: Várias
- Frequência nos adultos (%): 10-30
- Frequência nas crianças (%): 15
- Fatores Prognósticos Associados: Desfavorável
Anormalidade: Ikaros
- Alteração genética: IKZF1
- Frequência nos adultos (%): 25-35
- Frequência nas crianças (%): 12-17
- Fatores Prognósticos Associados: Desfavorável
t, translocação; p, braço curto do cromossomo; q, braço longo do cromossomo
LEUCEMIA AGUDA FENÓTIPO MISTO (LAFM) – DOENÇA RELACIONADA A LLA
A leucemia aguda com fenótipo misto, também conhecida como “leucemia de linhagem mista”, é um subtipo de leucemia aguda de linhagem ambígua. São duas formas de leucemia combinadas: leucemia linfoblástica aguda (LLA) e leucemia mielóide aguda (LMA). A leucemia aguda com fenótipo misto representa de 2 a 5% de todas as leucemias agudas que acometem pacientes de todas as idades e compreende vários subtipos diferentes.
A melhor abordagem para o tratamento não foi ainda definida. Não há terapia padrão para LAFM e, em geral, a doença está associada a um mau prognóstico. Isso se deve à dificuldade de identificar corretamente esse tipo de leucemia, sua incidência rara, falta de experiência no tratamento e sua resistência à terapia de LLA e LMA. As razões subjacentes a essa resistência ainda não estão claras, mas podem estar relacionadas à alta porcentagem de pacientes com LAFM que apresentam anormalidades citogenéticas.
Desenvolver a melhor abordagem de tratamento envolve considerar uma diversidade de fatores, incluindo a idade do paciente, histórico médico, presença de outras condições médicas relevantes e as características das células leucêmicas, conforme determinado por imunofenotipagem e estudos citogenéticos e moleculares. Também é importante determinar se um paciente tem um subtipo positivo para cromossomo Philadelphia (Ph+). Esse subtipo é responsável por cerca de 25% de todos os casos de LAFM. Pacientes com LAFM Ph+ são tratados com quimioterapia para a idade específica, em combinação com um inibidor de tirosina quinase (TKI), seguido de transplante alogênico de células-tronco, se necessário.
Para pacientes com um subtipo não Ph+ LAFM, o tratamento consiste em um regime de LLA ou uma combinação de terapia de LLA e LMA, possivelmente seguida de um tratamento de consolidação com um transplante alogênico, quando há um doador compatível.
LEUCEMIA AGUDA FENÓTIPO MISTO (LAFM) – DOENÇA RELACIONADA A LLA
A leucemia aguda com fenótipo misto, também conhecida como “leucemia de linhagem mista”, é um subtipo de leucemia aguda de linhagem ambígua. São duas formas de leucemia combinadas: leucemia linfoblástica aguda (LLA) e leucemia mielóide aguda (LMA). A leucemia aguda com fenótipo misto representa de 2 a 5% de todas as leucemias agudas que acometem pacientes de todas as idades e compreende vários subtipos diferentes.
A melhor abordagem para o tratamento não foi ainda definida. Não há terapia padrão para LAFM e, em geral, a doença está associada a um mau prognóstico. Isso se deve à dificuldade de identificar corretamente esse tipo de leucemia, sua incidência rara, falta de experiência no tratamento e sua resistência à terapia de LLA e LMA. As razões subjacentes a essa resistência ainda não estão claras, mas podem estar relacionadas à alta porcentagem de pacientes com LAFM que apresentam anormalidades citogenéticas.
Desenvolver a melhor abordagem de tratamento envolve considerar uma diversidade de fatores, incluindo a idade do paciente, histórico médico, presença de outras condições médicas relevantes e as características das células leucêmicas, conforme determinado por imunofenotipagem e estudos citogenéticos e moleculares. Também é importante determinar se um paciente tem um subtipo positivo para cromossomo Philadelphia (Ph+). Esse subtipo é responsável por cerca de 25% de todos os casos de LAFM. Pacientes com LAFM Ph+ são tratados com quimioterapia para a idade específica, em combinação com um inibidor de tirosina quinase (TKI), seguido de transplante alogênico de células-tronco, se necessário.
Para pacientes com um subtipo não Ph+ LAFM, o tratamento consiste em um regime de LLA ou uma combinação de terapia de LLA e LMA, possivelmente seguida de um tratamento de consolidação com um transplante alogênico, quando há um doador compatível.
LEUCEMIA LINFÓIDE AGUDA TEM CURA?
Um paciente Leucemia Linfóide Aguda tem duas opções de tratamento: padrão ou clínico experimental. É importante conversar com a equipe médica sobre a melhor opção de tratamento.
Um diagnóstico de LLA está associado a uma ampla gama de resultados. Portanto, é essencial procurar tratamento em um centro especializado. Os pacientes de LLA precisam de tratamento assim que recebem o diagnóstico. Se o quadro do paciente permitir, ele ainda pode buscar uma segunda opinião, para se sentir mais confiante.
Converse com seu médico sobre:
- Suas opções de tratamento e os resultados que você pode esperar
- Os resultados esperados com a terapia padrão
- Sobre a participação em um estudo clínico
Considerações quanto ao pré-tratamento. Adultos em idade fértil e pais de crianças com diagnóstico de LLA devem pedir ao médico informações sobre como lidar com o risco de infertilidade.
QUAIS OS TRATAMENTOS DISPONÍVEIS?
LEUCEMIA LINFOIDE AGUDA PROGNOSTICO
“Fatores prognósticos” são fatores que podem afetar a perspectiva ou o prognóstico do paciente e ajudam a prever uma expectativa de como a LLA de um paciente vai reagir ao tratamento. Esses fatores ajudam os médicos a planejar o tratamento inicial mais adequado, bem como os ajuda a determinar se o transplante de células-tronco é uma opção de tratamento e quando deve ser realizado.
Fatores prognósticos para crianças com LLA incluem:
- Idade: as células de leucemia em crianças com menos de 1 ano e crianças com mais de 10 anos tendem a ser mais resistentes ao tratamento, por isso tratamentos mais fortes podem ser necessários para eliminar estas células.
- Contagem de glóbulos brancos: as crianças com contagens de glóbulos brancos maior ou igual a 50.000/mm3 no momento do diagnóstico também necessitam de um tratamento mais intenso.
- Certas mudanças nos cromossomos (alterações citogenéticas) ou genes podem tornar as células de leucemia mais fáceis ou difíceis de serem tratadas.
- A presença de células de leucemia no líquido cefalorraquidiano e/ou nos testículos no momento do diagnóstico.
- Como o paciente responde à terapia de indução inicial. Pacientes que têm uma melhor resposta à terapia de indução, geralmente têm um menor risco de recaída da doença.
Crianças com LLA de alto risco de recidiva geralmente recebem tratamento mais intenso que crianças com LLA de risco padrão.
Fatores prognósticos para adultos com LLA incluem
- Idade: as células de leucemia em pacientes mais velhos tendem a ser mais resistentes ao tratamento. Pacientes com mais de 35 anos apresentam redução na duração da remissão, e maior dificuldade em tolerar aquimioterapia.
- Contagem de glóbulos brancos: os pacientes com contagens de glóbulos brancos superiores a 30.000/mm3 para a linhagem B e superiores a 100.000/ mm3 para a linhagem T no momento do diagnóstico geralmente tem duração da remissão reduzida.
- Certas mudanças nos cromossomos ou genes podem tornar as células da leucemia mais fáceis ou mais difíceis de serem tratadas.
- Se as células de leucemia são encontradas no líquido cefalorraquidiano no momento do diagnóstico.
- Como o paciente responde à terapia de indução inicial. Pacientes que respondem melhor à terapia de indução geralmente apresentam menor risco de recidiva.
COMO É O TRATAMENTO DE QUIMIOTERAPIA PARA LEUCEMIA LINFÓIDE AGUDA?

Quimioterapia
A quimioterapia é o tratamento de longo prazo mais utilizado para a LLA.
Geralmente dura cerca de 2 a 3 anos e é intensa, especialmente nos primeiros meses. A maioria dos tratamentos utilizam um coquetel de medicamentos.
Os medicamentos quimioterápicos eliminam as células de crescimento rápido em todo o corpo, tanto as células cancerosas, como as células normais e saudáveis, e funcionam de maneiras diferentes. Por isso é comum utilizar mais de um tipo de medicamento quimioterápico.
A quimioterapia é frequentemente administrada em ciclos. Cada ciclo é composto por um número de dias de tratamento seguidos por alguns dias de descanso, para que o corpo possa descansar e se recuperar. Os ciclos variam de duração, dependendo de quais quimioterápicos são usados.
Alguns medicamentos quimioterápicos são aplicados via intravenosa (na veia), e pode levar alguns minutos, horas ou vários dias (infusão contínua). A quimioterapia intravenosa é administrada por meio de um cateter, que será colocado cirurgicamente sob a pele na parte superior do tórax do paciente.
Veja como é o tratamento de quimioterapia para a Leucemia Linfóide Aguda
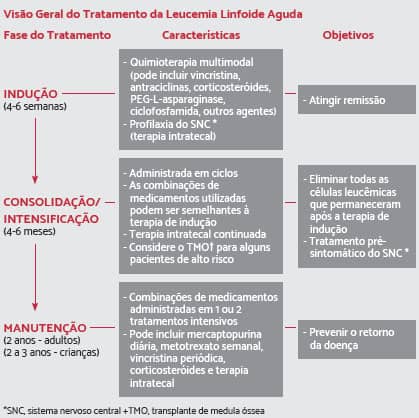
Existem três fases de tratamento que são mais comuns: indução, consolidação (ou intensificação) e manutenção. A consolidação e a manutenção são aplicadas após a remissão.
Terapia de Indução
É a fase inicial da quimioterapia. A medicação, as dosagens utilizadas e o momento da administração dependem de vários fatores, incluindo a idade, as características da leucemia e a saúde geral do paciente. O objetivo da terapia de indução é destruir o máximo de células da leucemia a fim de alcançar/induzir à remissão. Esta terapia geralmente utiliza vários medicamentos, que incluem: vincristina, antraciclinas (daunorrubicina, doxorrubicina) e corticosteroides (prednisona, dexametasona), administrados com ou sem asparaginase e/ou ciclofosfamida.
A gravidade da doença e os efeitos colaterais da terapia de indução podem levar a um período de internação de 4 a 6 semanas. Crianças e alguns pacientes que têm um cuidador e moram perto do centro médico são liberados para irem para casa mais cedo. Para algumas crianças, a permanência hospitalar é a primeira experiência delas fora de casa por um longo período de tempo. Informar sobre a doença e o tratamento de forma apropriada, ajudará a criança a confiar em você e na equipe de tratamento. Falar sobre seus medos e preocupações também ajudará seu filho a se sentir mais confortável.
Ao final da terapia de indução, os médicos irão avaliar se o paciente alcançou a remissão completa. Ela ocorre quando:
- Nenhuma célula de leucemia é detectada na medula óssea (com um microscópio)
- Tem menos de 5% de blastos na medula óssea
- Não tem blastos no sangue periférico
- As contagens de células do sangue voltam ao normal
- Todos os sinais e sintomas de LLA desapareceram
Mesmo quando uma remissão completa é alcançada, algumas células de leucemia que não podem ser vistas com um microscópio ainda podem permanecer no corpo. A presença dessas células é chamada de “doença residual mínima (DRM)”. Pacientes que chegaram à remissão após o tratamento inicial para LLA, mas têm DRM, têm maior risco de recidiva da doença.
Depois que um paciente atinge a remissão completa, a terapia pós-remissão é administrada para destruir todas as células de leucemia remanescentes no corpo.
O medicamento Blinatumomabe (Blincyto®) é aprovado para tratar adultos e crianças com LLA de células precursoras B em remissão, mas ainda com DRM maior ou igual a 0,1%. Geralmente, se os blastos ainda são evidentes após o primeiro ciclo de quimioterapia de indução, um segundo ciclo de quimioterapia, usando diferentes quimioterápicos, é indicado.
Profilaxia e Tratamento do Sistema Nervoso Central (SNC)
Embora a presença de blastos no líquido cefalorraquidiano ao diagnóstico não seja comum (3 a 7% dos casos), sem o tratamento profilático (preventivo) mais de 50% dos pacientes desenvolverão leucemia do SNC. Assim, a profilaxia é administrada a todos os pacientes durante todas as fases do tratamento para evitar que as células leucêmicas se espalhem para o cérebro e a medula espinhal.
A terapia dirigida ao sistema nervoso central pode incluir:
Quimioterapia intratecal
Os medicamentos são injetados na parte inferior da coluna, com a agulha entre duas vértebras (ossos da coluna), em uma área cheia de líquido que fica entre as finas camadas de tecido que cobrem o cérebro e a medula espinhal. Esses medicamentos podem incluir metotrexato, citarabina e dexametasona.
Quimioterapia sistêmica em altas doses
Os medicamentos injetados no sangue atravessam uma membrana entre o vaso de sangue e o SNC (barreira hematoencefálica) e incluem metotrexato, citarabina, dexametasona 6-mercaptopurina e asparaginase.
Irradiação craniana
É a radioterapia do cérebro. Em pacientes pediátricos (exceto se com leucemia do SNC ou recidiva do SNC) não é usada. O tratamento sem radiação diminui as chances de o paciente apresentar efeitos tardios, como danos aos órgãos, desenvolvimento de segundo câncer e ainda comprometimento neurocognitivo.
Alguns medicamentos usados para tratamento e/ou estudos clínicos de LLA são:
Antibióticos antitumorais
- Daunorubicina
- Doxorubicina
- Mitoxantrona
- Idarubicina
Inibidor de enzima de reparo de DNA
- Etoposide
Agentes que danificam o DNA
- Cyclophosphamide
- Ifosfamide
Enzimas que impedem as células de sobreviver
- Asparaginase
- Pegaspargase
Inibidores da tirosina quinase
- Mesilato de imatinibe
- Dasatinibe
- Nilotinibe
- Bosutinibe
- Ponatinibe
Antimetabólitos
- Clofarabina
- Citarabina
- Fludarabina
- Hidroxiureia
- 6-mercaptopurina
- Metotrexato
- Nelarabine
- 6-thioguanine
Drogas que impedem as células de se dividir
- Vincristina
- Sulfato de vincristina lipossomal
Hormônios sintéticos (corticoides)
- Prednisona
- Metilprednisolona
- Dexametasona
Imunoterapia
- Alemtuzumabe
- Rituximabe
- Ofatumumabe
- Blinatumomabe
- Inotuzumabe ozogamicina
- Tisagenlecleucel
Esta lista inclui tanto os medicamentos já utilizados no tratamento e os que estão sendo testados em estudos clínicos para o tratamento da LLA.
Terapia de consolidação (consolidação, reindução e manutenção)
Inclui os tratamentos administrados aos pacientes após a sua doença estar em remissão completa. Como na fase de indução, fatores como a idade do paciente, a capacidade de tolerar o tratamento intensivo, a citogenética, a disponibilidade de um doador de células-tronco e outras considerações, podem influenciar a abordagem do tratamento.
Consolidação
A segunda fase da quimioterapia é chamada de terapia de consolidação ou de “intensificação”. Terapia de consolidação é aplicada somente quando a LLA já está em remissão. O objetivo é destruir todas as células de leucemia remanescentes no corpo após a terapia de indução. Durante esta fase, os medicamentos quimioterápicos são administrados em doses mais altas que as administradas durante a fase de indução. A terapia de consolidação geralmente dura de 4 a 6 meses.
A combinação de medicamentos e a duração da terapia para protocolos de consolidação variam, mas podem consistir de combinações de drogas similares àquelas usadas durante a fase de indução. Após a fase de consolidação, alguns protocolos de tratamento fazem uma reindução, que consiste num tratamento intensificado, usando drogas semelhantes às da terapia de indução. Vários quimioterápicos são combinados para ajudar a impedir que as células de leucemia desenvolvam resistência.
Algumas das drogas usadas na fase de tratamento de consolidação incluem:
- Metotrexato em altas doses
- Citarabina
- Vincristina
- 6-mercaptopurina
- Blinatumomabe
- Inotuzumabe ozogamicina
- Ciclofosfamida
- Asparaginase
- Corticosteroides (prednisona, dexametasona).
MANUTENÇÃO DO TRATAMENTO DE QUIMIOTERAPIA PARA LEUCEMIA LINFOIDE AGUDA
A terceira fase do tratamento da LLA é chamada de “manutenção”. O objetivo é prevenir a recidiva da doença após a terapia de indução e a consolidação. A maioria dos medicamentos de manutenção são de administração oral e os pacientes são tratados em ambiente ambulatorial. Eles recebem doses mais baixas de quimioterápicos e, como resultado, tendem a ter efeitos colaterais menos graves. A terapia de manutenção geralmente dura cerca de 2 anos para adultos e 1 ano e meio a 2 anos, para crianças. Em alguns casos, a quimioterapia pós-remissão também inclui medicamentos que não foram utilizados durante o tratamento de indução. A maioria dos tratamentos de manutenção inclui:
- 6-mercaptopurina diariamente
- Metotrexato semanalmente
- Vincristina
- Corticosteroides (prednisona, dexametasona)
- Quimioterapia intratecal


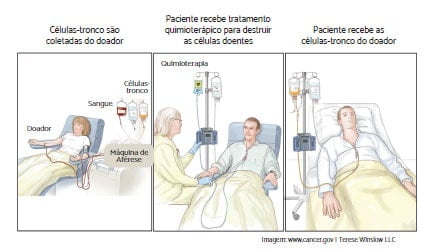
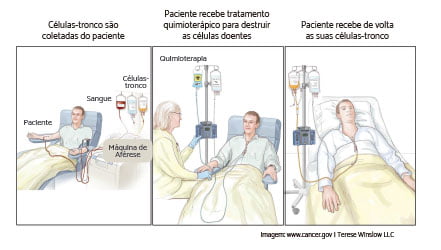



Nenhum comentário:
Postar um comentário
Vc é muito importante para mim, gostaria muito de saber quem é vc, e sua opinião sobre o meu blog,
bjs, Carla